研究方向
(1)新颖稳定多肽方法学的开发和生物医学应用:
蛋白-蛋白相互作用 (PPIs) 通常被视为药物发现的非药物性靶点,大多数PPIs包括少于15个氨基酸残基的短螺旋多肽,通过化学手段将多肽稳定在某一固定构象的稳定多肽是重要的调节PPI的代表性化合物。我们课题组的相关研究关注多肽工程战略,致力于发展新型多肽螺旋构象稳定方法,以解释稳定多肽的二级构象对其生物物理性能的影响。与此同时我们通过化学稳定的多肽来研究重要蛋白靶点的生物功能和作用机制,为探索更加有效的药物前体奠定基础。此外,我们还开发了新颖的锍盐策略,应用于蛋白修饰,ADC/PDC/ODC药物构建,活性氨基酸位点归类等多方面工作,已实现快速活细胞标记,基于活细胞的ABPP位点归类等新技术开发。
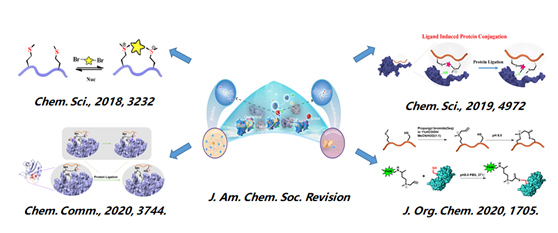
图1.基于锍盐的多肽稳定策略。
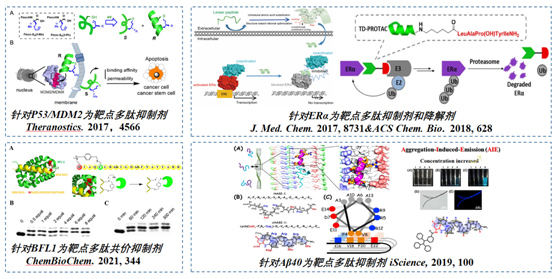
图2.应用生物学模型验证了课题组发展的稳定多肽方法在生物应用上的可行性。
(2)新颖的可控稳定多肽自组装核酸药物运载体的开发
核酸类药物是临床上用于治疗病毒感染性疾病、肿瘤、艾滋病的一类重要的药物,以RNAi效应为基础的siRNA药物由于易合成,可以靶向任意蛋白等性质,受到了广泛的关注。但是由于核酸类药物自身容易降解并且不易穿膜,因此迫切需要发展高效并且具有良好生物相容性的核酸运载体。近十年,纳米技术迅速的发展起来,为解决核酸药物的高效传递难题提供了新的思路。研发性能优越并且生物可降解的纳米材料,是将纳米技术推向实际临床应用的关键和难点。多肽作为一类生物体内自身存在的生物分子,具有非常高的生物相容性,并且被证明可以作为有效的核酸运载体,在生物医学领域的应用已经受到极高的关注。团队基于自主开发的“手性诱导螺旋的概念”构建了可以分子间自主装的siRNA运载体C-(RCES5)2和基于“S盐修饰的胞内可逆还原策略”构建了核酸诱导自组装的新型九肽运载体,能够高效的将核酸药物转运到不同的肿瘤细胞中,释放药物,抑制肿瘤生长。
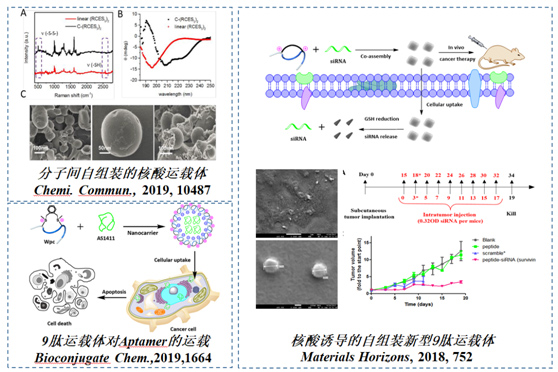
图3.基于稳定多肽方法开发的新型多肽核酸药物运载体。
(3)基于锍盐的多肽运载体免疫佐剂的开发
团队就如何提高肿瘤新抗原肽的免疫激活效果为出发点,提出将新型多肽纳米载体应用到新抗原的递送中,探究多肽纳米材料在肿瘤免疫治疗中的应用潜能。我们创新性的提出利用锍盐中心驱动策略实现免疫佐剂CpG与新抗原肽的可逆共价偶联,并借助核酸佐剂CpG的负电性诱导带有正电锍盐关环多肽材料的快速自组装,获得体系稳定、简单易制备、混合即用、且可包含多条肿瘤新抗原肽的共递送纳米平台。
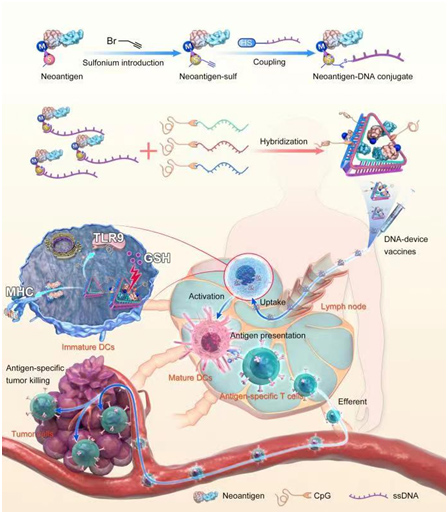
图4.新颖锍盐策略在免疫中的应用。

